La reconnaissance mutuelle et les équivalences entre ces systèmes sont extrêmement limitées.
这些系统之间的相互承认和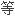 效受到极大限制。
效受到极大限制。
Un créancier judiciaire peut être autorisé à inscrire un avis de jugement dans le registre des opérations garanties ; l'inscription confère automatiquement une priorité équivalente à une sûreté générale sur les biens meubles du débiteur.
可以授权判决胜诉债权人在担保交易登记处登记判决通知,登记将对判决败诉债权人的动产自动产生与一般担保权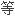 效的优先权。
效的优先权。
Sous sa forme actuelle, le projet d'instrument n'interdit pas l'utilisation de clauses standard à cet effet dans le document de transport (ou son équivalent électronique) et par conséquent ne prémunit pas contre les pratiques abusives.
采用现行形式的文书草案不排除在运输单据(或电子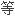 效物)中使用内容类似的标准条款,并因而无法防范滥用职责的行为。
效物)中使用内容类似的标准条款,并因而无法防范滥用职责的行为。
La CNUCED continuera également de collaborer avec l'Organisation pour l'alimentation et l'agriculture et la Fédération internationale des mouvements d'agriculture biologique dans le cadre de l'Équipe spéciale internationale sur l'harmonisation et l'équivalence des normes dans l'agriculture biologique.
贸发会议还将继续在有机农业中的统一性和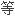 效性国际工作组的范围内与粮食和农业组织以及国际有机农业运动联合会合作。
效性国际工作组的范围内与粮食和农业组织以及国际有机农业运动联合会合作。
Une proposition tendant à examiner la question des problèmes juridiques posés par les équivalents électroniques de documents négociables et par d'autres systèmes électroniques de négociation et de transfert de sûretés n'a pas été retenue pour le moment.
另一项提议涉及关于可转让文件电子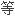 效件及权利谈判和转让其他电子系统的法律方面的今后工作,但这项提议已被暂时搁置。
效件及权利谈判和转让其他电子系统的法律方面的今后工作,但这项提议已被暂时搁置。
Approuvant les recommandations des experts, l'intervenant a insisté plus particulièrement sur les questions de la réduction des coûts de certification, en particulier pour les petits producteurs, des équivalences de normes et de la transparence et la simplicité des procédures d'importation.
他赞同专家们的建议,特别强调减少认证费用特别是小农户的认证费用、标准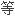 效和实行透明简化的进口程序
效和实行透明简化的进口程序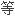 问题。
问题。
声明:以上例句、词性分类均由互联网资源自动生成,部分未经过人工审核,其表达内容亦不代表本软件的观点;若发现问题,欢迎向我们指正。